INTRODUCTION |
|
En cuniculture, la pathologie joue sans conteste un rôle majeur sur les coûts de production. Les enquêtes menées depuis plusieurs années en France par l'Institut Technique de l'Aviculture (ITAVI), aux travers de la Gestion Technico-Economique (GTE) des élevages de lapins de chair, indiquent que plus d'un quart des lapins meurent entre la naissance et la vente, aux environs de 75 jours d'âge. En 2006, la mortalité entre la naissance et la vente des animaux était de 26,7%, dont 8,5% pendant la période d'engraissement (Lebas 2007). En maternité, sur 3 jeunes lapines entrant dans une bande, une meurt avant la 3ème mise bas, l'autre est réformée pour cause de performances insuffisantes (infertilité) ou problème sanitaire, une seule assure une production prolongée. La morbidité, exprimée par des retards de croissance, une mauvaise conversion alimentaire ou un défaut d'homogénéité des animaux à la vente, par exemple, est beaucoup plus difficile à évaluer mais elle accroît certainement cet impact économique. La pathologie peut être abordée sous l'angle des maladies spécifiques : un agent infectieux correspond à une maladie. C'est ce qui sera fait dans cet article pour des raisons de commodité. Cependant, il ne faut pas perdre de vue que le développement d'une maladie est un équilibre entre la résistance de l'hôte et le pouvoir pathogène d'agents infectieux. Cette situation est d'autant plus complexe que d'autres facteurs, dits favorisants, sont très souvent impliqués. Parmi ces facteurs, il faut mentionner l'environnement, l'alimentation (Peeters et al 1995, Gidenne et Licois 2005), les stress, la qualité hygiénique des élevages ou d'autres facteurs spécifiques à l'animal lui-même tels que des prédispositions génétiques, le statut immunologique ou le statut sanitaire (Bennegadi et al 2001).Deux syndromes principaux sont classiquement identifiés chez le lapin : le syndrome respiratoire qui domine chez les adultes et le syndrome digestif, plus fréquent chez les lapins en croissance. En outre, en élevage rationnel, la pathologie liée à la reproduction (pathologie au nid ou des femelles elles-mêmes) qui n'est généralement pas associée à des phénomènes infectieux (Lebas et al 1996), devrait être prise en considération, même si elle ne sera pas développée dans cette présentation. D'autres pathologies bien connues en cuniculture concernent aussi bien les adultes que des lapins plus jeunes ; c'est le cas de maladies virales comme la maladie hémorragique virale (VHD) ou la myxomatose. Ces deux maladies virales ayant été passées en revue lors du dernier congrès mondial de cuniculture (Lavazza et Capucci, 2008.) et repris dans une synthèse récente (Licois et Marlier, 2008), ne seront pas non plus abordées ici.
Ne pouvant être exhaustif, nous ferons le point sur les principales maladies bactériennes et parasitaires pouvant être rencontrées dans les élevages rationnels de lapins de chair et sur les recherches développées au cours de ces dernières années concernant les agents étiologiques impliqués. Nous aborderons d’abord la pathologie infectieuse des mères puis celle des lapereaux.
|
| 1. Pathologie des reproductrices |
| 1.1 Pasteurellose |
|
La pasteurellose est l'une des pathologies les plus graves et fréquentes en cuniculture. C'est une maladie bactérienne récurrente due à Pasteurella multocida, seule espèce du genre qui existerait chez le lapin mais regroupant 3 sous espèces : subsp multocida, subsp gallicida et subsp septica (Mutters et al., 2005). Néanmoins Hoop et al. (2008), utilisant la rep-CR (repetitive extragenic palindromic – PCR), éléments répétitifs particuliers du génome amplifié par PCR (Polymerase Chain Reaction), associée au séquençage ont pu identifier P. canis de même qu'un groupe homogène d'une espèce inconnue appartenant à la famille des Pasteurellaceae. P. multocida affecte principalement, mais pas uniquement, le système respiratoire et les facteurs environnementaux peuvent jouer un rôle important. Selon Boucher et Nouaille (2002), 20 à 25% des animaux de réforme, présentent des lésions pulmonaires, essentiellement d'origine pasteurellique. La pasteurellose est économiquement importante car elle intervient également pour au moins 50% des causes de réforme des reproductrices. Il n'y a pratiquement pas d'élevages de lapins indemnes de pasteurelles et le portage sain est très répandu. Enfin la pasteurellose est médicalement grave car les moyens de lutte sont complexes et les traitements coûteux, longs et souvent inefficaces (Coudert et al 2006).
Le tableau clinique des pasteurelloses tel que décrit depuis le début du 20ème siècle n'a pas évolué même si son épidémiologie a profondément changé notamment de par l'intensification des échanges commerciaux, qui a entraîné la diffusion récente de certaines souches de pasteurelles. La pasteurellose se présente sous différentes formes cliniques :
- La forme respiratoire est la plus fréquente et selon le degré de sévérité de la maladie, les signes cliniques et les lésions varient d'une légère congestion nasale à de sévères pleuro bronchopneumonies exsudatives ;
- La forme abcédative est aussi une forme prépondérante en élevage rationnel où elle constitue la principale cause d'élimination des femelles (Coudert 1980). Les abcès ont des localisations très diverses (sous-cutanés, sous-séreux, sous-muqueux) touchant différentes parties du corps. Dans ce cadre, il faut considérer la localisation au niveau de l'oreille moyenne comme une atteinte majeure car l'évolution vers une Otite Moyenne Suppurée (OMS) est diagnostiquée chez plus de 60% des femelles (Coudert et al 1986) (Figure 1). Mais la plupart du temps ces OMS sont asymptomatiques. Sur le plan épidémiologique, les animaux atteints d'OMS jouent un rôle épidémiologique majeur. Non seulement ils représentent un réservoir de pasteurelles au sein de l'élevage mais, la diffusion des antibiotiques au niveau de l'oreille moyenne étant généralement mauvaise, la bactérie se trouve bien protégée de leur action ce qui peut expliquer les rechutes quasi systématiques après arrêt des traitements. Les lésions abcédatives des organes génitaux peuvent résulter d'une mauvaise pratique de l'insémination artificielle ;
- La forme septicémique est considérée comme une forme fatale, souvent séquelle des formes précédentes, notamment rhinites et pneumonies. Il n'y a généralement pas de signe clinique avant-coureur, la mort survenant rapidement. |
| |
|
Figure 1. Torticoli d'une lapine pouvant traduire une
atteinte pasteurellique de l'oreille moyenne. |

|
|
| |
|
L'agent étiologique, Pasteurella multocida est un coccobacille immobile asporulé, à Gram négatif, aéro anaérobie. Il est très sensible aux agents physicochimiques et peut être détruit en quelques min. à 60°C et en 1 à 2 jours en milieu sec ; il ne résiste que quelques jours à 4°C mais résiste plusieurs semaines dans les lisiers et dans les cadavres.
Eu égard à la multiplicité de formes de pasteurelloses, de nombreux travaux ont consisté à essayer de caractériser les différentes souches P. multocida. La caractérisation basée sur le sérotypage a été entreprise depuis très longtemps notamment celui basé sur les antigènes capsulaires. Cinq sérogroupes ont ainsi été définis : A, B, D, E. et F. Le sérogroupe A est de loin le plus répandu et le sérogroupe D le moins fréquent. Malheureusement les caractéristiques antigéniques seules ne suffisent pas à caractériser les souches de pasteurelles, ni selon leur pouvoir pathogène ni selon leur origine épidémiologique (Coudert et al 2006).
En conséquence, d'autres auteurs se sont orientés ces dernières années vers une caractérisation multiple des souches, basée sur leur morphologie, leur culture et la biochimie (Rideaud et Coudert 1994). Selon ces auteurs, il existe une corrélation positive entre le diamètre des colonies formées par des différentes souches de P. multocida et leur pouvoir pathogène pour le lapin. Selon les mêmes auteurs, la présence ou l'absence d'ornithine décarboxylase (ODC) chez P. multocida est un critère plus discriminant. Il a été montré que les souches sans ODC, quel que soit le diamètre des colonies, sont peu ou pas pathogènes. A l'inverse, les souches septicémiques ont toutes un très grand diamètre et sont ODC+.
Les recherches les plus récentes se sont focalisées sur la caractérisation moléculaire utilisant différentes méthodes de biologie moléculaire : ribotyping, REA (Restriction Enzyme Analysis), RAPD (Random Amplified Polymorphic DNA), rep-PCR (Coudert et al 2006).
La pathogénicité et la virulence varient fortement en fonction des souches de P. multocida. Elles peuvent être divisées en trois catégories, selon l'intensité du pouvoir pathogène (Coudert et al 2006) : 1/ celles pour lesquelles la mortalité atteint 100% en moins de 24 h pour 1000 unités formant colonie (ufc) inoculées au niveau des narines (souches septicémiques) ; 2/ celles qui entraînent de 20 à 80% de mortalité en 2 à 5 jours, avec des lésions organiques graves ; 3/ celles qui ne provoquent aucune mortalité même après inoculation de 106 ufc.
Les souches se différencient également selon la nature des lésions et leur affinité pour certains organes. Outre les souches septicémiques, il existe des souches pyogéniques, hémolytiques, ou dont les tropismes hépatique, splénique ou pulmonaire sont plus ou moins prononcés. Le diagnostic de suspicion se base sur l'observation des signes cliniques (fréquence des formes respiratoires et des abcès cutanés, mammites, etc., mortalité autour de la mise bas. Cependant un diagnostic final reste toujours difficile à poser car il n'y a pas de signes cliniques pathognomoniques ; la plupart d'entre eux peuvent être imputables à des staphylocoques ou même à des klebsielles. En conséquence, seules les analyses bactériologiques permettent de poser un diagnostic de confirmation. Des tests PCR peuvent néanmoins être réalisés (Townsend et al 2001).
En termes d'immunité et d'immunogénicité, si l'infection par P. multocida est susceptible de conduire à la production d'anticorps à des titres élevés, la protection des animaux n'est que très limitée (Coudert et al 2006). Bien que le niveau de résistance générale des souches de pasteurelles soit relativement limité, les traitements aux antibiotiques sont assez décevants dans la mesure où les rechutes sont quasi systématiques. Les résultats les plus probants ont été obtenus par utilisation de tétracycline, de streptomycine associée ou non à la spriramycine, ou d'enrofloxacine (Boucher et Nouaille 2002). La prévention reste donc la meilleure arme. Elle est tout d'abord hygiénique avec le dépistage des animaux à risques et leur élimination systématique sur la base de signes cliniques évidents. Une parfaite maîtrise des conditions d'ambiance est également primordiale. Enfin, une prophylaxie médicale peut être tentée sachant qu'à ce jour les meilleurs résultats sur le terrain sont toujours obtenus par des autovaccins. Une autre voie d'approche qui concerne la résistance génétique à la pasteurellose est engagée par les généticiens de l'INRA de Toulouse (Helloin et al., 2009).
|
| 1.2 Staphylococcie |
|
La staphylococcie est aussi une maladie récurrente qui peut être grave en cas de crise. Connue chez le lapin depuis le début du 20ème siècle, elle était peu fréquente avant les années 80. Elle a fait son apparition dans les élevages rationnels entre 1982 et 1985 (Boucher et Nouaille 2002). Selon ces auteurs, depuis 1992, l'incidence de cette pathologie en élevage a singulièrement augmenté parallèlement au développement de l'élevage en bandes.
La bactérie responsable, Staphylococcus aureus, infecte le lapin au niveau de microlésions cutanées avant d'envahir les tissus sous-cutanés. Les principaux signes cliniques sont des pododermatites (abcès plantaires), des mammites et des abcès sous-cutanés. Moins fréquemment, des abcès peuvent se développer au niveau de différents organes tels que les poumons, le foie, le coeur, l'utérus. Des formes septicémiques sont également observées. Les signes cliniques associés aux abcès sont des baisses de production, de l'infertilité voire de la mortalité. Chez les jeunes sous la mère on peut observer des sévères dermatites aiguës exsudatives et abcédatives. Souvent ces lapereaux meurent à cause de l'agalactie due aux mammites chez les mères (Vancraeynest et al 2006).
Deux types d'infection ont été décrits. Dans le premier cas, les signes cliniques sont observés chez un petit nombre d'individus dans une bande. L'infection est alors due à des souches dites de faible virulence LV (Low Virulence) et dont l'impact économique est de faible importance. Pour le second type, la maladie prend un aspect épizootique dans tout l'élevage, entraînant des problèmes chroniques, une diminution de la production et de la mortalité. Les souches impliquées sont dans ce cas des S. aureus de forte virulence HV (High Virulence) (Hermans et al 1999). La quasi-totalité des lapins est porteur du germe avec prédominance de souches LV.
Les bactéries du genre Staphylococcus sont des coques à Gram positif, classiquement disposés en amas. Les souches de S. aureus ont été caractérisées sur la base de leur biotype (propriétés biochimiques particulières des isolats). Il est apparu cependant que le biotypage ne permettait pas de distinguer les souches à haute virulence de celle à faible virulence dans les élevages. Aussi d'autres méthodes de typage ont été mises en oeuvre pour différencier les souches (Vancraeynest et al 2006).
La lysotypie (utilisation de bactériophages spécifiques) a montré que les souches de S. aureus LV cunicoles appartiennent à une grande variété de lysotypes (Hermans et al 1999). Par ailleurs, comme pour d'autres agents pathogènes, les outils de la biologie moléculaire ont considérablement fait progresser les connaissances au cours des deux dernières décades, en particulier sur les caractéristiques génotypiques des S. aureus du lapin et ont apporté beaucoup d'informations en termes d'épidémiologie. Parmi les techniques de génotypage employées, l'électrophorèse en champs pulsés (PFGE - pulsed-gel electrophoresis) est considérée actuellement comme la méthode de choix pour le typage des souches de S. aureus. Cette technique a permis ainsi de montrer que toutes les souches HV du lapin, étaient clonales et que ce pathotype était responsable de graves problèmes dans de nombreux pays européens (Vancraeynest et al 2006).
La transmission de la maladie s'effectue souvent au départ de porteurs sains. Elle peut se faire par contacts directs ou indirects par du matériel souillé et surtout par les mains de l'éleveur qui, compte tenu des manipulations spécifiques des animaux (palpation de femelles par exemple), constitue un risque supplémentaire. Le sperme, y compris lorsque l'insémination artificielle est pratiquée, représente aussi un risque potentiel de transmission de souches HV. Les lapereaux au nid sont très sensibles à l'infection sans pour autant toujours présenter de signe clinique et ce, y compris après le sevrage. La période d'entrée en production est un facteur de risque (Boucher et Nouaille 2002).
Les études portant sur la pathogénicité de S. aureus indiquent que les souches HV infectent les lapins plus facilement que les souches LV (Hermans et al 2000), probablement parce que les pathovars HV ont une forte capacité à coloniser les épithéliums de l'animal hôte (Hermans et al 1999).
Le diagnostic s'effectue après isolement et caractérisation des souches de S. aureus, généralement à partir du pus des abcès. La bactériologie est par ailleurs le seul moyen de différencier une pasteurellose d'une car les signes cliniques et lésionnels de ces deux maladies sont souvent comparables. La caractérisation des souches et la distinction entre pathovars HV et LV reposent sur les techniques précédemment décrites. Il faut y ajouter la PCR multiplex proposée par Vancraeynest et al (2007). Le contrôle de la staphylococcie chez des lapins infectés par des souches LV, qui ne diffusent pas au sein des élevages, repose davantage sur des méthodes préventives associées à une hygiène très rigoureuse. Le recours à une antibiothérapie adaptée peut être envisagé mais toujours sur la base des résultats d'un antibiogramme car, contrairement aux pathovars HV, les souches LV présentent de nombreuses résistances (Vancraeynest et al 2004).
Lors d'infection par des souches HV, l'antibiothérapie même ciblée et la désinfection de l'environnement sont généralement inefficaces, les rechutes étant fréquentes comme pour les pasteurelloses,. Dans de nombreux cas, l'élimination de la totalité des animaux, une désinfection poussée de l'élevage et un repeuplement avec un nouveau troupeau issus d'un élevage non contaminé sont requis. En conséquence, on peut penser que le dépistage d'animaux porteurs des souches HV devrait être la règle, à condition de disposer de tests rapides, efficaces et peu coûteux, ce qui n'est toujours pas possible à ce jour (Vancraeynest et al 2006).
Aucun vaccin n'est encore disponible, l'immunisation vis-à-vis de la staphylococcie se révélant particulièrement difficile. Cependant, la prophylaxie vaccinale reste une voie de recherche. Il a notamment été mis en évidence des protéines secrétées spécifiquement par les souches HV et non par les souches LV. S'il s'avère que ces protéines interviennent comme facteurs de virulence, elles pourraient être à l'origine d'un nouveau type de vaccin (Vancraeynest et al 2006).
|
| 2. Pathologie des lapereaux après sevrage |
| |
|
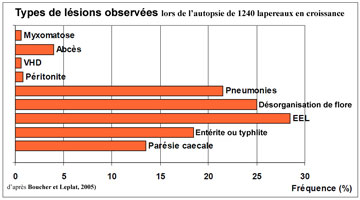
Les affections digestives constituent la cause essentielle de la morbidité et de la mortalité, chez le lapin de chair en croissance. Selon une analyse de Boucher et Leplat (2005), concernant 1240 autopsies de lapereaux en engraissement issus des Pays de Loire, du Nord, de la Normandie et du Sud, les affections digestives concernaient 72% des animaux, alors que 26% des lésions touchaient l'appareil respiratoire et 2% une autre organe. La fréquence des lésions observée dans cette étude est indiquée sur la figure 2. Les étiologies de ces affections restent encore parfois difficiles à établir car les signes cliniques ne sont pas pathognomoniques. L’un d’entre eux, la diarrhée, est largement dominant : on la rencontre dans plus de 95% des cas. C’est surtout chez les jeunes lapins après le sevrage (4 à 10 semaines) que la diarrhée revêt une importance économique grave. On la rencontre parfois chez le jeune lapereau sous la mère ou plus rarement chez les adultes où elle représente généralement la conséquence ultime d’une autre affection. |
| |
|
| Figure 2. Fréquence des lésions observées à partir des autopsies de 1240 lapereaux en croissance (Boucher et Leplat, 2005). |
|
|
| |
|
Parmi les causes spécifiques des entéropathies on identifie les coccidies, parasites qui constituent l'étiologie majeure des troubles intestinaux et des complications d’origine parasitaire chez le lapin en élevage rationnel et certaines espèces bactériennes : Escherichia coli entéropathogènes, Clostridium (C. spiroforme et plus exceptionnellement C. piliforme), Klebsiella pneumoniae, etc. Les pathologies digestives non imputables à un agent pathogènes spécifiques sont généralement regroupées sous le vocable «d'entérites non spécifiques». Ces dernières, d'origine multifactorielle ne seront pas présentées dans cette synthèse. Par contre, une description sera faite de l’Entéropathie Épizootique du Lapin (EEL), une maladie émergente présente dans les élevages depuis 1997 et pour laquelle l’agent étiologique n’est pas encore connu à ce jour. |
| 2.1 Pathologie parasitaire : coccidioses |
| |
|
Dans les élevages modernes les affections dues aux parasites externes responsables de gales ou de teignes ont quasiment disparues, de même que les endoparasitoses dues aux nématodes (vers intestinaux). Exceptionnellement des oxyuroses dues à Passalurus ambiguus sont encore parfois signalées mais elles sont alors le signe d'une hygiène insuffisante. Les parasites qui peuvent induire de lourdes pertes en élevage restent les coccidies, notamment intestinales. Les coccidioses sont dues à des coccidies, parasites communs du tractus digestif de nombreuses espèces animales. Ce sont des protozoaires du phylum «Apicomplexe» qui appartiennent, chez le lapin, au genre Eimeria. Elles ont un développement intracellulaire et constituent une étiologie importante des troubles et des complications d'origine intestinale.
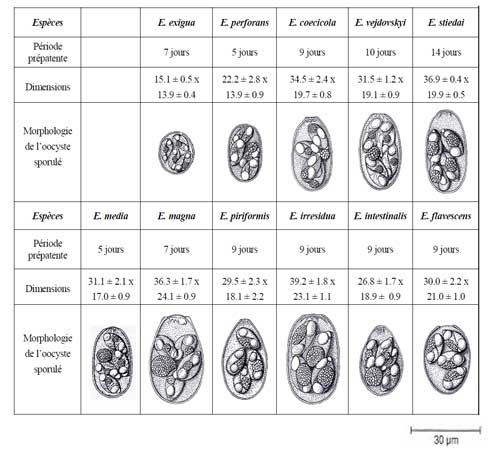
Elles sont monoxèmes (un seul hôte) et ont une spécificité très poussée vis-à-vis de l'espèce animale qu'elles parasitent. Onze espèces ont été identifiées chez le lapin. Leur description a été rapportée par Eckert et al (1995). Dans la pratique, l'identification des diverses espèces est basée principalement sur les critères morphologiques de l'oocyste qui en raison de sa grande variabilité de taille et de forme est extrêmement difficile (Tableau 1). D'autres caractéristiques permettent d'identifier les coccidies : période prépatente, durée de la sporulation, tropisme différentiel pour les segments intestinaux (Coudert et al 1995). Les profils génomiques de l'ADN parasitaire sont également utilisables au niveau de la recherche (Ceré et al 1995). |
| |
|
Tableau 1. Période prépatente, dimensions (longueur x largeur) et morphologie des oocystes des différentes Eimeria du lapin (Coudert et al., 1995 ;
Eckert et al., 1995). |
|
|
| |
|
Le cycle du parasite qui comprend différentes phases conduit à la production d'un nombre considérable d'oocystes. Avec la publication sur le développement endogène d'E. exigua (Pakandl et al 2008), la phase interne du cycle de la quasi-totalité des espèces aura été étudiée en microscopie électronique. Ces études auront permis de démontrer une particularité des Eimeria du lapin qui n'existe pas pour les coccidioses aviaires. Deux types de schizontes se développent en parallèle au cours des différentes schizogonies de la phase de multiplication asexuée. Initialement décrit par Streun et al (1979), le premier, dit type A, correspond à des schizontes hébergeant des mérozoites polynucléés, aboutirait à la formation des microgamontes et des microgamètes. Le second type, B, est caractérisé par des schizontes contenant davantage de mérozoites, mononucléés et conduirait à la constitution des macrogamontes et macrogamètes.
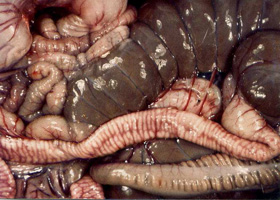
Le pouvoir pathogène des coccidies varie selon les espèces (Coudert et al 1995). Certaines sont peu ou pas pathogènes comme E. perforans ou E. coecicola ; d'autres sont extrêmement pathogènes comme E. flavescens ou E. intestinalis. Les lésions macroscopiques visibles au niveau des segments intestinaux concernés sont dominées par un aspect très segmenté associé une congestion et un oedème de la paroi intestinale (Figure 3). Au niveau microscopique, on observe seulement une hypertrophie des entérocytes, la structure cellulaire restant intacte jusqu'au moment ou elles éclatent et se détachent de la muqueuse en libérant les oocystes. |
| |
|
| Figure 3. Lésion intestinale d'une coccidiose à Eimeria intestinalis. L'iléon est marqué par une structure segmentée associée à un oedème de la muqueuse. |
|
|
| |
|
En termes d'immunogénicité et d'immunité, il est établi de longue date que l'inoculation de coccidies induit l'apparition d'anticorps circulants mais que ceux-ci ne sont pas protecteurs. Ainsi la mère ne transmet aucune immunité protectrice à ses lapereaux. Seule, l'immunité à médiation cellulaire confère une réelle protection. Il n'y a aucune immunité croisée entre les espèces et l'immunogénicité varie d'une espèce à l'autre. Les travaux les plus récents soulignent le rôle de l'immunité locale (Renaux et al 2003, Pakandl et al 2008).
Les traitements utilisés à titre curatif sont basés sur l'emploi de sulfamides dont le plus efficace est la sulfadiméthoxine. Le toltrazuril (Baycox), anticoccidien de synthèse qui n'a pas encore d' Autorisation de Mise sur le Marché (AMM) pour le lapin est néanmoins aussi très efficace.
La prophylaxie médicale repose sur l'utilisation d'anticoccidiens distribués en continu dans l'aliment excepté pendant la période de retrait précédent la vente des animaux. Deux molécules ont une AMM lapin : la robénidine (guanidine) utilisable en engraissement et chez les reproducteurs sous le nom actuel de Cycostat 66 et la salinomycine (ionophore) utilisable uniquement en engraissement. Le diclazuril, autre molécule de synthèse vient (fin 2008) d'obtenir une AMM lapin. Malheureusement des chimiorésistances se sont développées chez certaines espèces, pour la robénidine notamment, et la diffusion de coccidies résistantes à cette molécule (E. magna, E. media et E. perforans) est maintenant généralisée sur le terrain. Néanmoins, la robénidine reste une molécule de choix en ce qui concerne toutes les autres espèces et en particulier contre les plus pathogènes.
La vaccination demeure cependant une voie prometteuse. Pour le moment, seuls des vaccins vivants présentent une certaine efficacité. Des souches à pouvoir pathogène atténué, dites souches précoces, car à cycle plus court que celui des souches sauvages dont elles dérivent ont été obtenues pour différentes espèces (Licois et al 1994, 1995, Pakandl et Jelínková 2006). Les modalités de vaccination sur le terrains ont été testées, la meilleure solution consistant à vaporiser les souches vaccinales directement dans la boîte à nid, lorsque les lapereaux ont 25 j d'âge (Drouet-Viard et al 1997). Des recherches sont par ailleurs actuellement poursuivies, à l'INRA de Tours, visant à une meilleure connaissance des mécanismes moléculaires et cellulaires de la pathogénicité afin si possible d'identifier de nouvelles cibles thérapeutiques.
|
| 2.2 Pathologies bactériennes |
| 2.2.1 Colibacilloses |
|
Les Colibacilles (Escherichia coli) sont des hôtes normaux de la flore intestinale de nombreuses espèces animales. Cependant certaines souches peuvent représenter un des agents étiologiques les plus importants de troubles intestinaux chez les animaux. Chez le lapin, la richesse de la flore colibacillaire est limitée : moins de 104-105 ufc d'E. coli/g de contenu cæcal ; certains lapins n'hébergeant pas d'E. coli. Par contre, tout dérèglement digestif peut se traduire par une sévère colidysbactériose, à savoir une forte élévation de la flore colibacillaire saprophyte jusqu'à 108-109 ufc d'E. coli /g de contenu cæcal. Les E. coli responsables de diarrhées primaires ont été classés dans au moins cinq catégories. Les E. coli pathogènes du lapin appartiennent au pathovar EPEC (entéropathogenic E. coli). Ces colibacilles entéropathogènes du lapin (REPEC) sont comparables aux EPEC humains. Ils s'attachent à la muqueuse intestinale et provoquent des lésions spécifiques d'attachement/effacement (A/E) au niveau de la bordure en brosse des entérocytes (effacement des microvillosités). Ils ne produisent pas d'entérotoxines thermostables ou thermolabiles connues et ne sont pas entéro-invasives.
Les différents pathotypes peuvent être différentiés sur la base de leur sérotype, de la mobilité des souches et du biotype. Les données épidémiologiques indiquent que les souches de E. coli hautement pathogènes pour le lapin en engraissement, pouvant induire expérimentalement jusqu'à 90% voire 100% de mortalité, appartiennent aux sérotypes O15:H-, prédominant en Belgique et aux Pays-Bas alors que le sérotype O103:H2:K- rhamnose négatif prédomine en Italie, Espagne et France. Les souches O26:H11 sont également très pathogènes alors que d'autres sérogroupes (O132 et O128 par exemple) sont d'une pathogénicité moindre, entraînant des diarrhées, des retards de croissance et une faible mortalité. Chez les lapereaux sous la mère ce sont les souches O109:K- :H2 qui sont les plus pathogènes. Elles interviennent parfois avant l'âge de quinze jours (Boullier et Millon 2006).
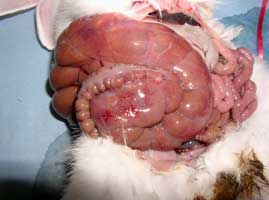
Les lésions macroscopiques observées lors de colibacillose aiguë sont généralement limitées à la partie terminale de l'intestin grêle, au cæcum et au côlon. Le contenu intestinal est anormalement liquide et une inflammation variable de ces différents segments, parfois associée à des zones hémorragiques est visible (Figure 4). |
| |
|
Figure 4. Lésions intestinales d'un lapin infecté expérimentalement par une souche pathogène d'Escherichia coli O103. Suffusions hémorragiques à la surface du cæcum dont le contenu est très liquide et hémorragique. |
|
|
| |
|
Par microscopie optique, on peut observer des E. coli attachés à la muqueuse intestinale. Sous les zones colonisées, la lamina propria est infiltrée de polymorphonucléaires. En microscopie électronique, on observe l'effacement des microvillosités et les E. coli sont fixés à la membrane cellulaire des entérocytes sur des formations appelées «piédestals» riches en actine (Peeters et al 1984, Licois et al 1991).
Grâce aux outils de la biologie moléculaire et à l'utilisation de modèles in vivo et in vitro (cultures cellulaires), des progrès considérables ont été réalisés depuis le début des années 90 sur la connaissance des facteurs de virulence et les mécanismes de pathogénicité des EPEC du lapin (Milon et al 1999, Boullier et Milon 2006). Ces travaux, parallèlement à ceux effectués chez les EPEC d'origine humaine, ont permis de mieux caractériser les EPEC. Il a été mis en évidence l'importance de gènes plasmidiques et chromosomiques dans les processus d'attachement/effacement des bactéries aux entérocytes et aux perturbations physiopathologiques associées à la diarrhée. Les gènes impliqués dans les lésions A/E sont regroupés dans un îlot de pathogénicité appelé LEE (Locus d'Entéro Effacement). La description détaillée de l'adhésion des EPEC aux cellules hôtes a été passée en revue par Nougayrède et al (2003) et Boullier et Milon (2006).
La meilleure connaissance des facteurs de virulence, en particulier ceux médiés précisément par les gènes du LEE et le développement de l'ingénierie moléculaire ont permis de proposer des méthodes de diagnostic plus fines et de nouvelles stratégies de vaccination.
Concernant la caractérisation des souches des E. coli du lapin, des cibles moléculaires sont maintenant utilisées pour identifier les différents pathotypes. Outre l'antigène somatique O, le sérotypage et le biotypage (capacité des souches à fermenter certains sucres), certains auteurs ont recherché par PCR, la présence du gène eae (Blanco et al 1997). Plus récemment la technique de microarrays a été utilisée pour identifier d'autres gènes de virulence (Tonelli et al 2008).
A noter que les souches de sérogroupe O2, très fréquemment rencontrées dans les élevages français, à des niveaux parfois élevés dans la flore intestinale du lapin atteints de diarrhée, ne possèdent aucun des facteurs de pathogénicité décrits ci-dessus.
En ce qui concerne les traitements et la prophylaxie, c'est cette deuxième approche qui a été privilégiée au cours de ces dernières années en mettant l'accent sur la prophylaxie vaccinale, plus spécifiquement par voie orale. La découverte des gènes de virulence du LEE et des mécanismes pathogéniques sous-jacents a conduit à la construction de souches mutantes pour lesquelles certains gènes ont été inactivés. Expérimentalement, la protection induite avec de telles souches s'avère bonne lorsque l'on veut protéger vis-à-vis de souches appartenant au même sérogroupe (souches homologues). Par contre l'efficacité vis-à-vis de souches hétérologues reste limitée (Boullier et Milon, 2006) .
|
| 2.2.2 Clostridioses |
|
Le lapin peut héberger de nombreuses espèces de Clostridium (Marlier et al 2003) mais très peu d'entres elles sont reconnues comme des pathogènes primaires à l'exception de C. spiroforme et de C. piliforme. Le pouvoir pathogène réel de C. perfringens est toujours sujet à de nombreuses discussions.
|
| |
|
Clostridium spiroforme |
| |
|
Les entérotoxémies associées à des Clostridium sont connues depuis longtemps chez le lapin. Elles sont caractérisées soit par une paralysie intestinale entraînant une accumulation de gaz dans l'estomac et l'intestin, soit par une entérite avec diarrhée remplaçant une constipation opiniâtre. Dans les deux cas, l'évolution habituelle est la mort des animaux. A l'autopsie, l'intestin est dilaté par des gaz. Le côlon et l'intestin grêle renferment une substance gélatineuse et, quelquefois des traînées congestives avec des suffusions hémorragiques peuvent être observées sur le cæcum. La bactérie incriminée a d'abord été Clostridium perfringens. En effet, Patton et al (1980) avaient mis en évidence l'intervention possible chez des lapins atteints d'entérite, d'une toxine, la toxine iota de Clostridium perfringens de type E, sans qu'ils aient pu pour autant isoler cette bactérie. Notons que C. perfringens de type E est plutôt décrit chez les ovins et les bovins, et pas chez le lapin. Ultérieurement, Carman et Borriello (1982) établissent une corrélation entre la présence de la toxine iota (ou iota like) et celle d'une autre bactérie, Clostridium spiroforme, dans le contenu digestif de lapins atteints de diarrhée.
D'une manière générale, C. spiroforme est surtout retrouvé dans les stades terminaux des troubles digestifs et cette bactérie est souvent associée à d'autres agents pathogènes (coccidies, virus, EPEC…). En France, C. spiroforme est diagnostiqué dans environ 10% des examens effectués en laboratoire (Boucher et Nouaille, 2002). Selon les années, au niveau du terrain, elle peut être parfois la bactérie émergeante dominante (Le Normand communication personnelle). En Italie, elle est aussi l'un des principaux germes isolés de lapins atteints d'entérites (Agnoletti et al 2004). |
| |
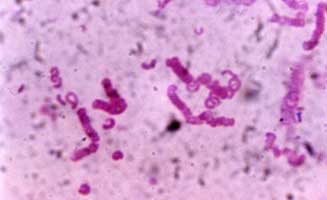
|
Figure 5. Forme hélicoïdale caractéristique de Clostridium spiroforme |
|
|
| |
|
C. spiroforme est une bactérie à Gram+, immobile, anaérobie stricte susceptible de sporuler. Elle a une forme semi-circulaire et l'enchaînement de bactéries les unes derrières les autres représente une forme hélicoïdale caractéristique (Figure 5). Les formes végétatives sont détruites à la chaleur (80°C pendant 10 min.) mais les spores résistent à cette température.
La pathogénicité est liée au fait que la plupart des souches sont toxinogènes. C. spiroforme produit une toxine binaire qui cause une destruction et une desquamation des cellules épithéliales et une typhlite hémorragique. Dans ce dernier cas, la quantité de toxine iota like présente dans le cæcum est suffisante pour tuer des souris. Certains antibiotiques, (clindamycine, lyncomycine) de même qu'une alimentation trop riche en protéines ou en fibres digestibles, favorisent la multiplication de C. spiroforme.
Le diagnostic est essentiellement bactériologique, la clinique et le tableau lésionnel pouvant être confondus avec d'autres pathologies (Marlier 2006) (Figure 6). Il peut être réalisé par bactérioscopie directe du contenu cæcal après coloration de Gram, ou après centrifugation du contenu intestinal et observation de l'interface culot-surnageant. Un milieu de culture spécifique a été proposé par Agnoletti et al (2004). Enfin l'identification par PCR vient d'être relatée par Drigo et al (2008). |
| |
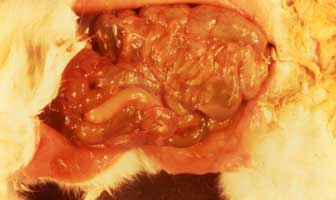
|
Figure 6. Lésion intestinale associée à une diarrhée profuse chez un lapin infecté par Clostridium spiroforme,: congestion du cæcum au contenu très liquide |
|
|
| |
|
La prévention repose sur des règles d'hygiène habituelles, sur une alimentation adaptée et sur une antibiothérapie raisonnée. En cas de problèmes en élevage l'accent portera sur des mesures de désinfection entre les bandes car C. spiroforme est une bactérie qui peut sporuler. Il n'y a pas de vaccin commercialement disponible pour prévenir cette maladie. De manière expérimentale, des résultats prometteurs ont été obtenus en immunisant des animaux au moyen de toxoïdes préparés au départ de surnageant de culture de C. spiroforme. Les traitements antibiotiques les plus adaptés sont la spiramycine et l'enrofloxacine (Boucher et Nouaille 2002) de même que la bacitracine. |
| |
|
Clostridium piliforme (maladie de Tyzzer) |
| |
|
Clostridium piliforme est l'agent de la maladie de Tyzzer, identifié pour la première fois en 1917, chez la souris de laboratoire. Il s'agit d'un bacille intracellulaire dénommé initialement Bacillus piliformis, mais reclassé depuis dans le genre Clostridium sur la base des analogies de séquences des ARN 16S. La maladie de Tyzzer a été décrite dans de nombreuses espèces animales dont le lapin et a été identifiée en France (Licois 1986). Elle a rarement été signalée en élevage industriel mais quand elle se manifeste cela peut être économiquement préoccupant pour l'éleveur (Peeters et al 1985, Le Normand et al 2005).
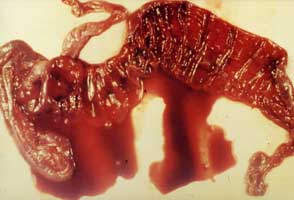
La maladie de Tyzzer chez le lapin revêt deux formes. La forme chronique est caractérisée par une diarrhée aqueuse, des retards de croissance et une mortalité inférieure à 5%. Les cas aigus apparaissent chez des lapins, généralement après le sevrage mais peuvent aussi concerner les adultes (Le Normand et al 2005). Les lésions macroscopiques intestinales sont celles d'une entérite hémorragique nécrosante affectant surtout la partie postérieure de l'intestin (iléon, cæcum, côlon). Le cæcum est le plus affecté ; il est le siège d'un oedème très prononcé au niveau de la séreuse et de la sous-muqueuse. Le cæcum prend souvent une couleur rouge vif (Figure 7). Bien que nettement plus rare chez le lapin que chez les rongeurs, une infection hépatique peut être présente chez le lapin. |
| |
|
Figure 7. Lésions intestinales d'un lapin atteint de la maladie de Tyzzer. Le cæcum, très hémorragique, est le siège d'un oedème important |
|
|
| |
|
L'agent de la maladie de Tyzzer est une bactérie mobile à Gram négatif, pléomorphe, décelable à l'hématoxyline-éosine et visualisée par le Giemsa. Il existe une forme filamenteuse typique qui correspond à la forme de multiplication de cette bactérie et des bâtonnets épais et courts, moins nombreux que la forme filamenteuse.
Le diagnostic est particulièrement difficile à poser car la bactérie ne se cultive pas sur milieu inerte (Licois 1986, Marlier 2006). L'un des meilleurs moyens pour identifier le germe est l'histologie après coloration par imprégnation argentique (technique de Wartlin Starry ou Levatidi). L'isolement et la multiplication de cette bactérie sont cependant possibles sur oeuf embryonné, sur cultures cellulaires ou par passage sur souris. Des tests PCR, plus spécifiques que les tests sérologiques ont été mis au point (Furukawa et al 2002, Niepeceron et Licois 2007, Niepceron et al., 2009).
Les traitements antibiotiques sont le plus souvent illusoires en raison de la rapidité d'évolution de la maladie, de la formation de spores et de la localisation intracellulaire de C. spirofome. Toutefois les meilleurs résultats sont obtenus avec les cyclines (Le Normand et al 2005). Une désinfection poussée de l'élevage au moyen de désinfectants sporicides doit être associée à ce traitement. |
| 2.2.3 Entéropathie Epizootique du lapin (EEL) |
| |
|
L'entéropathie épizootique du lapin (EEL) est une maladie émergeante, très contagieuse qui a fait son apparition en France, fin 96-début 97 (Licois et al 1998, Marlier et Vindevogel 1998). A l'origine, elle était caractérisée sur le terrain, en l’absence d’antibiothérapie, par des ballonnements abdominaux considérables et des diarrhées aqueuses lorsque la maladie se déclare, associées à des taux de mortalité très élevés (30 à 80%). Malgré des améliorations conséquentes apportées au cours des dernières années pour réduire l'impact d l'EEL sur le terrain (généralisation de l'élevage en bandes, rationnement alimentaire, meilleure maîtrise des facteurs environnementaux…) cette pathologie reste une contrainte majeure pour la filière cunicole en France et en Europe, voire dans d'autres pays dans le monde. On sait en effet maintenant que d'autres continents (Amérique centrale) sont concernés (Rodriguez-De Lara et al 2008). |
| |
|
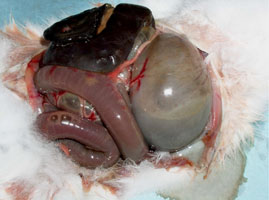
Figure 8. Lésions intestinales d'un lapin, après reproduction expérimentale de l'EEL. L'estomac et l'intestin grêle, fortement dilatés par un contenu très liquide et des gaz, sont responsables d'une distension de l'abdomen. Le cæcum est le siège d'une parésie cæcale. Aucune inflammation ni congestion n'est visible au niveau de l'intestin. |
|
|
| |
|
L’EEL se distingue des autres pathologies intestinales connues chez le lapin par un tableau clinique et lésionnel spécifique. Outre la diarrhée et la mortalité, on observe généralement un ballonnement abdominal prononcé dû à une dilatation de tous les segments du tractus digestif y compris l’estomac dont les contenus sont très liquides (Figure 8). Ces symptômes sont parfois associés à une parésie cæcale et à la présence de mucus, notamment dans le côlon et parfois dans l’intestin grêle. Ce qui est le plus caractéristique, en l'absence de pathologie intercurrente, est qu'aucune lésion macroscopique de congestion ou d’inflammation n’est visible, en particulier au niveau du cæcum, alors que cet organe est le siège privilégié de lésions typiques d’entérites aiguës pour les autres pathologies du tractus gastro-intestinal.
Par contre, l'EEL présente de nombreuses similitudes avec une pathologie décrite antérieurement sous les vocables d’entérite mucoïde ou d’entéropathie mucoïde (Van Kruiningen et Williams 1972). Malgré l'investissement de plusieurs équipes, l'agent pathogène de cette maladie n'est toujours pas identifié. Un inoculum de référence (dénommé TEC), en partie caractérisé, a été mis au point et a permis, grâce à l'utilisation de lapins EOPS, de bien définir la maladie (Licois et al 2005). Cet inoculum a été mis à la disposition de la communauté scientifique pour des recherches étiologiques ou pour la mise en oeuvre de moyens de prévention adaptés (Licois et al 2006). Le principal objectif de recherche aujourd'hui reste donc à identifier et si possible isoler, l'agent étiologique responsable de la maladie, avec à terme la mise au point d'un vaccin.
Le rôle direct de l'aliment (taux et/ou nature des matière premières, mycotoxines, pesticides, prémix) a été écarté. Par contre le rôle de l'aliment comme vecteur potentiel a été démontré. De même, l'hypothèse qu'un virus soit impliqué comme agent primaire dans le développement de la maladie est maintenant exclue (Licois 2007, Szalo et al 2007). Des avancées significatives sur cette entité pathologique complexe, ont été obtenues ces dernières années dans notre laboratoire : Il s'agit notamment de la mise en évidence d'une perturbation très précoce indépendante de l'utilisation d'antibiotiques qui eux contrôlent la maladie. L'implication d'une substance toxique soluble, thermosensible (détruite à 85°C – 10 min.) dans cette perturbation précoce a été démontrée (Licois, 2007). Des fractionnements ont révélé que le produit toxique pourrait être de nature protéique et de petit poids moléculaire. L'étape de recherche actuelle vise donc à identifier cette entité moléculaire.
D'un autre côté, l'exploration de la piste bactérienne a progressé principalement suite aux travaux menés en collaboration entre le centre INRA Tours et la Clinique Aviaire, des Rongeurs et Lagormorphes de l'Université de Liège (Prof. D. Marlier). Pris dans leur globalité et tenant compte des résultats parfois contradictoires, les conclusions des travaux menés à ce jour sont que l'étiologie de l'EEL serait d'origine bactérienne, vraisemblablement une bactérie plutôt de type anaérobie mais aérotolérante, non cultivable sur milieux usuels et produisant une toxine agissant très rapidement en début d'infection. Le rôle direct de divers agents pathogènes opportunistes a pu être écarté par inoculation expérimentale. En ce qui concerne Cl. perfringens, cette bactérie pourrait jouer un rôle dans les mortalités importantes observées en élevage mais ne serait pas la cause primaire de l'EEL (Licois et al 2003, Huybens et al 2008, Marlier et al 2006, Szalo et al 2007). |
|
AGNOLETTI F., BANO L., DEOTTO S., COMIN D., PARENTI E., MARCATI M., BERTOLIN M., MAZZOLINI E., 2004. Selective culture medium to isolate Clostridium spiroforme from rabbit gut. Proc. 8th World Rabbit Congress, Sept. 2004, Puebla, Mexico, WRSA ed., 410-415.
BENNEGADI N., GIDENNE T., LICOIS D., 2001. Impact of fibre deficiency and sanitary status on non-specific enteropathy of the growing rabbit. Anim. Res., 50, 401-413.
BLANCO J.E., BLANCO M., BLANCO J., MORA A., BALAGUER L., CUERVO L., BALSALOBRE C., MUNOA F., 1997. Prevalence and characteristics of enteropathogenic Escherichia coli with eae gene in diarrhoeic rabbits. Microbiol. Immunol., 41, 77-82.
BOUCHER S., LEPLAT A., 2005. De quoi meurent nos lapins. In Table Ronde : "Effets des conduites post-sevrage sur les performances et la santé des lapereaux". 11 èmes Journ. Rech. Cunicole, 29-30 nov., Paris, France, http://www.asfc-lapin.com/Docs/Activite/T-ronde- 2005/Tables-rondes-01a.htm (accédé 27 mai 2009).
BOUCHER S., NOUAILLE L., 2002. Maladies des lapins. France Agricole, 2ème éd. 272p. BOULLIER S., MILLION A., 2006. Rabbit colibacillosis. In: Recent advances in rabbit sciences, Maertens L., Coudert P. (Ed), ILVO, Melle, Belgique, 171-179.
CARMAN R.J., BORRIELLO S.P., 1982. Clostridium spiroforme isolated from rabbits with diarrhea. Vet. Rec., 11, 461-462.
CERE N., LICOIS D., HUMBERT J.F., 1995. Study of the interand intraspecific variation of Eimeria spp. from the rabbit using the random amplified polymorphic DNA. Parasitol. Res., 81, 324-328.
COUDERT P., 1980. Pathologie et conduite de l'élevage des lapines reproductrices. Point Vét., 10, 61-65.
COUDERT P., RIDEAUD P., BALENÇON M., 1986. Pasteurellose non respiratoire en élevage intensif : l'otite moyenne des lapines reproductrices. Cuni-Sciences, 3, 1-6.
COUDERT P., LICOIS D., DROUET-VIARD F., 1995. Eimeria and Isospora. Eimeria species and strains of rabbits. In: Biotechnology. Guidelines on Techniques in Coccidiosis Research; Eckert J., Braun R., Shirley M.W., Coudert P. (Ed). Office for official publications of the European communities. Luxembourg, 52-73.
COUDERT P., RIDEAU P., VIRAG G., CERRONE A., 2006. Pasteurellosis in rabbit. In: Recent advances in rabbit sciences, Maertens L., Coudert P. (Ed), ILVO, Melle, Belgique, 147-162.
DRIGO I., BACCHIN C., COCCHI M., BANO L., AGNOLETTI F., 2008. Development of PCR protocols for specific identification of Clostridium spiroforme and detection of sas and sbs genes.Vet. Microbiol., 131, 414-418.
DROUET-VIARD F., COUDERT P., LICOIS D., BOIVIN M., 1997. Vaccination against Eimeria magna coccidiosis using spray dispersion of precocious line oocysts into the nestbox. Vet. Parasitol., 70, 61-66.
ECKERT J., TAYLOR M., LICOIS D., COUDERT P., CATCHPOLE J., BUCKLAR H., 1995. Identification of Eimeria and Isospora Species and Srains. Morphological and biological characteristics. In: Biotechnology. Guidelines on Techniques in Coccidioisis Research. Eckert J., Braun R., Shirley M.W., Coudert P. (Ed), Office for official publications of the European communities. Luxembourg, 103-119.
FURUKAWA T., FURUMOTO K., FUJIEDA M., OKADA E., 2002. Detection by PCR of the Tyzzer’s disease organism (Bacillus piliformis) in feces. Exp. Anim., 51, 513-516.
GIDENNE T, LICOIS D., 2005. Effect of a high fibre intake on the resistance of the growing rabbit to an experimental inoculation with an enteropathogenic strain of Escherichia coli. Anim. Sci., 80, 281-288.
HELLOIN E., GARREAU H., SLUGOCKI C., HILGENBERG M., LE BEUX C., LICOIS D., BOUCHER S., LE NORMAND B., MORIN H., BAUMIER L.M., COISNE F., FOURNIER F., MORENO C., LANTIER F., 2009. Vers une amélioration de la résistance du lapin à la pasteurellose. 13èmes Journ. Rech. Cunicole, 17-18 nov., Le Mans, France
HERMANS K., DE HERDT P., DEVRIESE L.A., HENDRICKX W., GODARD C., HAESEBROUCK F., 1999. Colonization of rabbits with Staphylococcus aureus in flocks with and without chronic problems of staphylococcosis. Vet. Microbiol., 67, 37-46.
HERMANS K., DE HERDT P., DEVRIESE L.A., GODARD C., HAESEBROUCK F., 2000. Colonisation of rabbits with Staphylococcus aureus after experimental infection with high and low virulence strains. Vet. Microbiol., 72, 277- 284.
HOOP R., STAHELA A., KORCZAK B., 2008. Molecular characterization and phenotyping of Pasteurella from swiss rabbits. Proc. 9th WRSA, World Rabbit Congress, June 10-13, Verona, Italy, 965-969.
HUYBENS N., HOUEIX J., SZALO M, LICOIS D., MAINIL J., MARLIER D., 2008. Is epizootic rabbit enteropathy (ERE) a bacterial disease? Proc. 9th WRSA, World Rabbit Congress, June 10-13, Verona, Italy, 971-975.
LAVAZZA A., CAPUCCI L., 2008. Viral infections of rabbits. Proc. 9th WRSA, World Rabbit Congress, June 10-13, Verona, Italy, 879-894.
LEBAS F., 2007. Productivité des élevages cunicoles professionnels en 2006. Résultats de RENALAP et RENACEB. Cuniculture Mag., 34, 31-39.
LEBAS F., COUDERT P., ROCHAMBEAU H. DE, THEBAULT R.G., 1996. Le Lapin : Elevage et pathologie. Organisation des Nations Unies pour l’Alimentation et l’Agriculture, Rome 1996. Collection FAO : production et santé animales, 19, 229p.
LE NORMAND B., LICOIS D., NIEPCERON A., CHATELLIER S., 2005. Description d’un cas de maladie de Tyzzer en élevage intensif de lapins de chair. 11èmes Journ. Rech. Cunicole, 29-30 nov. Paris, France, 241-243.
LICOIS D., 1986. La maladie de Tyzzer. Ann. Rech. Vét., 17, 363-386.
LICOIS D., 1998. Bilan des travaux réalisés à l’INRA, sur l’Entérocolite Epizootique, dans l’hypothèse d’une étiologie virale. 7èmes Journ. Rech. Cunicole, 13-14 mai, Séance d’actualité : l’Entérocolite Epizootique. Lyon, France, 20-26. LICOIS D., 2007. Etude in vivo de la fraction surnageante de l'inoculum TEC4, inoculum utilisé pour la reproduction expérimentale de l'Entéropathie Epizootique du Lapin. 12èmes Journ. Rech. Cunicole, 27-28 nov., Le Mans, France, 217-220.
LICOIS D., MARLIER D. 2008. Pathologie infectieuse du lapin en élevage rationnel. INRA Prod. Anim. 21, 257-268.
LICOIS D., REYNAUD A., FEDERIGHI M., GAILLARD-MARTINIE B., GUILLOT J.F., JOLY B., 1991. Scanning and transmission electron microscopic study of adherence of Escherichia coli 0103 enteropathogenic and/or enterohemorrhagic strain GV in enteric infection in rabbits. Infect. Immun., 59, 3796-3800.
LICOIS D., COUDERT P., DROUET-VIARD F., BOIVIN M., 1994. Eimeria media: selection and characterization of a precocious line. Parasitol. Res., 80, 48-52.
LICOIS D., COUDERT P., DROUET-VIARD F., BOIVIN M., 1995. Eimeria magna: Pathogenicity, immunogenicity and selection of a precocious line. Vet. Parasitol., 60, 27-35.
LICOIS D., DEWREE R., COUDERT P., VINDEVOGEL H., MARLIER D., 2003. Essais de reproduction expérimentale de l'entéropathie épizootique du lapin (EEL) avec des inoculums originaires de Belgique et des Pays-Bas et avec des souches bactériennes isolées de ces inoculums ainsi que de TEC2 et TEC3 (inoculums INRA). 10 èmes Journ. Rech. Cunicole, 19-20 nov., Paris, France, 255- 258.
LICOIS D., WYERS M., COUDERT P., 2005. Epizootic rabbit enteropathy: experimental transmission and clinical characterization. Vet. Res., 36, 601-613.
LICOIS D., COUDERT P., MARLIER D. 2006. Epizootic rabbit enteropathy. In: Recent advances in rabbit sciences, Maertens L., Coudert P. (Ed), ILVO, Melle, Belgique, 163- 170.
MARLIER D., 2006. Enteritis and enterotoxaemia in rabbits. Diagnosis and typing of clostridia in medical and food microbiology. Duchesnes C., Menozzi M.G., Pelkonen S., Granum P.E., Peck M.W., Popoff M., Titball R., Stackebrandt E., Mainil J. (Eds), 88-90.
MARLIER D., VINDEVOGEL H., 1998. L’Entérocolite Epizootique du lapin. Ann. Med. Vet., 142, 281-284.
MARLIER D., DEWREE R., LICOIS D., COUDERT P., LASSENCE C., POULIPOULIS A., VINDEVOGEL H., 2003. L'Entéropathie Epizootique du Lapin (EEL) : un bilan provisoire des résultats après 20 mois de recherches. 10èmes Journ. Rech.Cunicole. 19-20 nov., Paris, France, 247-250.
MARLIER D., DEWREE R., LASSENCE C., LICOIS D., MAINIL J., COUDERT P., VINDEVOGEL H., 2006. Infectious agents associated with epizootic rabbit enteropathy: isolation and attempts to reproduce the syndrome. Vet. J., 172, 493- 500.
MILON A., OSWALD E., DE RYCKE J., 1999. Rabbit EPEC: a model for the study of enteropathogenic Escherichia coli. Vet. Res., 30, 203-219
MUTTERS R., CHRISTENSEN H., BISGAARD M, GENUS I. Pasteurella Trevisan 1887, 94AL Nom. cons. Opin. 13, Jud. Comm. 1954b, 153. In: D.J. Brenner, N.R. Krieg, J.T. Staley and G.M. Garrity, Editors, Bergey's Manual of Systematic Bacteriology, Spinger, New York (2005), pp. 857–866
NIEPCERON A., LICOIS D., 2007. Mise au point d'une technique dite de «nested PCR» (PCR nichée) pour la détection de Clostridium piliforme, agent de la maladie de Tyzzer. 12èmes Journ. Rech.Cunicole. 27-28 nov., Le Mans, France, 223-226.
NIEPCERON A., LICOIS D., 2009. Development of a highsensitive nested PCR assay for the detection of Clostridium piliforme in clinical sample. Vet. J., (in press).
NOUGAYREDE J.P., FERNANDES P.J., DONNENEBERG M.S., 2003. Adhesion of enteropathogenic Escherichia coli to host cells. Cell. Microbiol., 5, 359-372.
PAKANDL M., JELÍNKOVÁ A., 2006. The rabbit coccidium Eimeria piriformis: Selection of a precocious line and lifecycle study. Vet. Parasitol., 137, 351-354.
PAKANDL M., HLÁSKOVÁ L., POPLSTEIN M., NEVECERALOVÁ M., VODICKA T., SALÁT J., MUCKSOVÁ J., 2008. Immune response to rabbit coccidiosis: a comparison between infections with Eimeria flavescens and E. intestinalis. Folia Parasitol., 55, 1-6.
PATTON N.M., HOLMES H.T., RIGGS R.J., CHEEKE P., 1980. Rabbit enterotoxemia. Proc. 2nd Congr. World Rabbit Sci. Ass., 15-18 avril, Barcelone, Espagne, 393-401.
PEETERS J.E., CHARLIER G.J., HALEN P.H., 1984. Pathogenicity of attaching effacing enteropathogenic Escherichia coli isolated from diarrheic suckling and weanling rabbits for newborn rabbits. Infect. Immun., 46, 690-696.
PEETERS J.E., CHARLIER G., HALEN P., GEEROMS R., RAEYMAEKERS R., 1985. Naturally occuring Tyzzer's disease (Bacillus piliformis infection) in commercial rabbits: a clinical and pathological study. Ann. Rech. Vét., 16, 69-79.
PEETERS J. E., MAERTENS L., ORSENIGO R., COLIN M., 1995. Influence of dietary beet pulp on cæcal VFA, experimental colibacillosis and iota-enterotoxaemia in rabbits. Anim. Feed Sci. Technol., 51, 123-139.
RENAUX S., QUERE P., BUZONI-GATEL D., SEWALD B., LE VERN Y., COUDERT P., DROUET-VIARD F., 2003. Dynamics and responsiveness of T-lymphocytes in secondary lymphoid organs of rabbits developing immunity to Eimeria intestinalis. Vet. Parasitol., 110, 181-95.
RIDEAUD P., COUDERT P., 1994. Identification des souches pathogènes de Pasteurella multocida chez le lapin. 6èmes Journ. Rech. Cunicole, La Rochelle, France, 1, 113-120.
RODRIGUEZ-DE LARA R, CEDILLO-PELAEZ C, CONSTANTINOCASAS F, FALLAS-LOPEZ M, COBOS-PERALTA MA, GUTIERREZ-OLVERA C, JUAREZ-ACEVEDO M, MIRANDAROMERO LA. 2008. Studies on the evolution, pathology, and immunity of commercial fattening rabbits affected with epizootic outbreaks of diarrhoeas in Mexico: a case report. Res. Vet. Sci., 84,:257-268.
STREUN A., COUDERT P., ROSSI G.L., 1979. Characterization of Eimeria species. II. Sequential morphologic study of the endogenous cycle of Eimeria perforans (Leuckart, 1879 ; Sluiter and Swellengrebel, 1912) in experimentally infected rabbits. Z. Parasitenkd., 60, 37-53.
SZALO I.M., LASSENCE C., LICOIS D., COUDERT P., POULIPOULIS A., VINDEVOGEL H., MARLIER D., 2007. Fractionation of the reference inoculum of epizootic rabbit enteropathy in discontinuous sucrose gradient identifies aetiological agents in high density fractions. Vet. J., 173, 652-657.
TONELLI A., BADAGLIACCA P., BRUANT G., LETIZIA A., DI PROVVIDO A., HAREL J., SCACCHIA M., 2008. Genetic characterization of rabbit Escherichia coli strains with the use of microarray technology. Proc. 9th World Rabbit Congress, June 10-13, Verona, Italy, 1097-1102.
TOWNSEND K.M., BOYCE J.D., CHUNG J.Y., FROST A.J., ADLER B., 2001. Genetic organization of Pasteurella multocida cap Loci and development of a multiplex capsular PCR typing system. J. Clin. Microbiol., 39, 924-929.
VANCRAEYNEST D., HERMANS K., MARTEL A., VANEECHOUTTE M., DEVRIESE L.A., HAESEBROUCK F., 2004. Antimicrobial resistance and resistance genes in Staphylococcus aureus strains from rabbits. Vet. Microbiol., 101, 245-251.
VANCRAEYNEST D., HERMANS K., HAESEBROUCK F., 2006 Recent advences in rabbit staphylococcosis research. In: Recent advances in rabbit sciences, Maertens L., Coudert P. (Ed), ILVO, Melle, Belgique, 133-138.
VANCRAEYNEST D., HAESEBROUCK F, HERMANS K., 2007. Multiplex PCR assay for the detection of high virulence rabbit Staphylococcus aureus strains. Vet. Microbiol., 121, 368-372.
VAN KRUININGEN J.H., WILLIAMS C.B., 1972. Mucoid enteritis of rabbits. Comparison to cholera and cystic fibrosis. Vet. Pathol., 9, 53-77. |
|